Клиника испытаний – новые правила | Павленко Евгений Валерьевич | МИГ, 15 декабря 2010 г. | СТРАХОВАНИЕ СЕГОДНЯ, прогноз
22.08.2018

   Полный список прогнозов
  Полный список прогнозов Обязательное страхование , Новые страховые поля , Новый страховой продукт , Страхование жизни , Страхование от несчастных случаев
Обязательное страхование , Новые страховые поля , Новый страховой продукт , Страхование жизни , Страхование от несчастных случаев
Система приема пациентов в городской больницы претерпела изменения
В сентябре 2010 года вступил в силу законопроект «Об обращении лекарственных средств». Новый закон вводит процедуру обязательного страхования пациентов при проведении клинических испытаний лекарственных препаратов. Жизнь и здоровье пациента, участвующего в исследованиях, должна будет за свой счет страховать организация, получившая разрешение на проведение клинических испытаний.
"Звёздные яйца" - Столичные Пижоны VS Заезжая Лимита | Выпуск #5 от 28.09.2017
Сфера клинических испытаний в России достаточно закрыта. Как быстро может измениться ситуация в новых условиях – вопрос не сколько времени, сколько инвестиций в реорганизацию производства и развития рынка клинических испытаний. Мы видим предпосылки для вполне успешного роста рынка в 2011 году.
Рынок страхования жизни и здоровья пациентов
Рынок клинических испытаний складывается из нескольких больших сегментов:
исследования биоэквивалентности (совместимость с другими препаратами); локальные клинические испытания, проводимые для российского рынка; международные многоцентровые клинические исследования.Как видно на графике, самым крупным сегментом из перечисленных является область клинических исследований, проводимых на международной многоцентровой основе – около 60% в 2009 году.
Второй сегмент по количеству – это локальные клинические испытания, проводимые для российского рынка (около 25% в 2009 году). Они проводятся как западными, так и российскими фармацевтами.
Наименьшее количество исследований проводится в области проверки биоэквивалентности – около 15% в 2009 году.
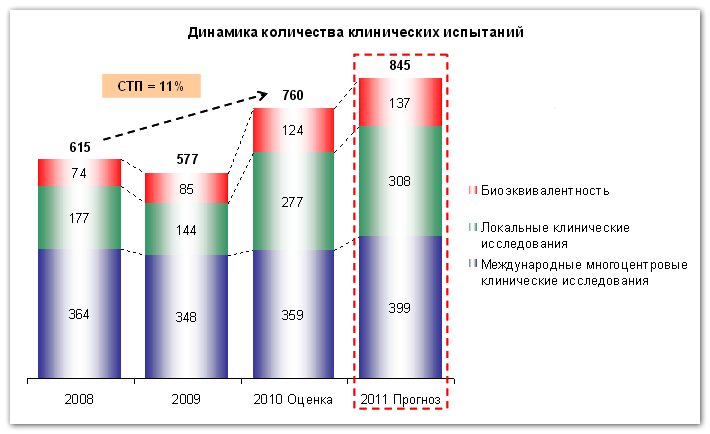
Согласно данным сборника «Клинические исследования в России. Оранжевая книга» исследовательской группы Synergy по итогам I полугодия 2010 года было проведено 312 клинических испытания лекарственных средств. Как показывают расчеты, по итогам текущего года количество исследований вырастет до величины 760 испытаний. Вместе с тем, количество клинических испытаний в будущем году вырастет на прогнозную величину около 11% и по итогам 2011 года составит 845 клинических испытаний.
Одновременно в будущем году будет расти и количество пациентов вовлеченных в тестовые программы. По оценкам УМР НСГ, количество человек прошедших через данные программы, составит около 110 тысяч человек по итогам 2010 года, а в 2011 достигнет величины 139 тысяч человек. Необходимо отметить, что, вероятно, количество пациентов в различных сегментах будет расти разными темпами. Как следствие, наиболее быстрорастущим сегментом окажется исследование биоэквивалентности.

УМР НСГ был сделан прогноз сборов страховой премии на основе количества пациентов-участников клинических исследований, величине страховой премии по конкретному виду клинических испытаний и коэффициентам, оговоренным в Типовых правилах. Расчет проводился для трех условных сегментов данного рынка. С результатами можно ознакомиться в таблице.
Прогноз сборов премии по страхованию клинических испытаний в 2011 году
| Тип клинического исследования | Премия на 1 пациента, руб. | Количество пациентов | Коэффициент тарифа | Страховые сборы, млн. руб. | Доля вида клинических испытаний в сборах премии по виду, % |
| Международные многоцентровые клинические исследования | 9 811 | 57 788 | 0,9 | 510 | 69% |
| Локальные клинические исследования | 3 804 | 56 215 | 0,9 | 192 | 26% |
| Биоэквивалентность | 1 445 | 25 879 | 0,9 | 34 | 5% |
| Всего | – | 139 883 | – | 736 | 100% |
Как видно из расчетов, до 70% премии в 2011 году принесут страховщикам международные фармацевтические концерны, проводящие многоцентровые клинические исследования.
Остальные 30% сборов, скорее всего, будут распределены между прочими сегментами: локальными исследованиями и изучением биоэквивалентности.
В целом, данный рынок в 2011 году принесет страховщикам около 736 миллионов рублей страховой премии, при условии, что среднее количество пациентов, вовлеченных в испытание, окажется в диапазоне от 100 до 200 пациентов в одной группе, а общее количество пациентов в России достигнет прогнозируемых 139 тысяч человек.
Российский рынок клинических исследований
За последние годы наблюдается интенсивный рост как общего количества международных клинических исследований с участием России, так и рост количества вовлеченных в исследования центров на территории России. В первом квартале 2010 года Росздравнадзор РФ выдал 134 разрешения на все виды клинических испытаний, это на 18% больше, чем в соответствующем квартале прошлого года.
Сегодня Росздравнадзор допускает проведение клинических испытаний на базе 1500 лечебных учреждений.
Первое место среди отечественных производителей по количеству исследований, начатых в 2009 году, занимала ОАО Валента, инициировавшее 13 клинических испытаний. На втором месте — ЗАО «Фармацевтическое предприятие Оболенское» с таким же количеством исследований, но меньшим количеством пациентов; на третьем — «Канонфарма» (12). На четвертом — ЗАО «Биокад» (9). На пятом – «Микроген» с 8 новыми исследованиями.
В клинических испытаниях, начатых в I квартале 2010 года, принимает участие больше 13 тысяч пациентов, это на треть больше, чем в соответствующем квартале прошлого года.
Клинические испытания становятся как бы «моментом истины» для вновь разработанных лекарственных препаратов. На основании результатов испытаний и решается вопрос о целесообразности применения препарата во врачебной практике. От качества клинических исследований медицинских препаратов на добровольцах зависит успех по продвижению препарата в целом.
Проведение клинических испытаний становится частью процесса регистрации нового лекарства в России. Мировая практика вывода нового лекарства на рынок подразумевает длительные масштабные исследования эффективности и безопасности лекарственного препарата. Насколько этот процесс будет затянут в России, зависит от сроков ожидания разрешения проведения испытаний. С учетом того, что обычно фармкомпаниям приходится ждать разрешения несколько месяцев, угроза приостановки исследований становится реальной.
Правила
Положением закона предусмотрено проведение дополнительных клинических испытаний с участием российских пациентов при регистрации в России испытанных и зарегистрированных за рубежом лекарственных средств.
Согласно типовым правилам обязательного страхования жизни, здоровья пациента, участвующего в клинических исследованиях лекарств организаторы клинического исследования обязываются прилагать к договору обязательного страхования участвующих в исследовании пациентов их поименный список, с указанием паспортных данных, места работы и места жительства. Таким образом, документ требует раскрытия персональных данных пациентов третьим лицам (фармкомпаниям, страховщикам), что противоречит нормам медицинской этики и международной практике проведения клинических исследований 1.
Новая редакция закона вызвала немало дискуссий на тему отличий от ранее действующих условий страхования.
В качестве оптимального варианта для получения разрешения на проведение клинических испытаний НСГ предлагает заключить предварительный договор с организатором исследований. Индивидуальные полисы страхования каждого пациента, участвующего в клинических испытаниях, выдаются после оформления договора обязательного страхования. НСГ гарантирует защиту персональных данных и конфиденциальность полученной информации.
Вопросов остается много. И у нас есть установка на разработку механизма, который поможет соблюдать все необходимые нормативы и урегулировать противоречия, затрудняющих работу страхователей и страховщиков.
1 Общепринятая основа проведения клинических испытаний во всех странах мира базируется на защите прав и достоинства человека, определенных в Хельсинской декларации 1964 года, подписанной всеми государствами. вернуться »15 декабря 2010 г.
Версия для печати
 Смотрите другие материалы по этой тематике: Обязательное страхование , Новые страховые поля , Новый страховой продукт , Страхование жизни , Страхование от несчастных случаев
Предыдущие отзывы:
3 января 2011 г. 16:44 Автор отзыва
Смотрите другие материалы по этой тематике: Обязательное страхование , Новые страховые поля , Новый страховой продукт , Страхование жизни , Страхование от несчастных случаев
Предыдущие отзывы:
3 января 2011 г. 16:44 Автор отзыва
tolko russkie dolzhny podtverdit kachestvo preparatov
17 марта 2012 г. 08:39 Гаянэ заказ статьи на платной основеМне очень понравилась данная статья, у нас в Казахстане только приступают к клиническим многоцентровым испытаниями, отсутствуют соответствующее законодательство о страховании людей, поэтому Вас опубликоваться в нашем журнале "Фармацевтический бюллетень" на платной основе по данной тематике


